Acceso abierto
Nuevos desafios
María B. Nallino (1), Paola Acevedo (1), Ivana Fernández (1), Ana I. Fumagalli (2), Adriana Ojeda (1)
(1) Especialista en Neurorradiología
(2) Especialista en Neurología
Diagnóstico Médico Oroño – Bv. Oroño 1526, Rosario (2000), Argentina
Sanatorio Parque – Bv. Oroño 860, Rosario (2000), Argentina
Correspondencia a: belunallino@hotmail.com
Fecha de publicación: 10/05/2024
Citación sugerida: Nallino MB, Acevedo P, Fernández I y col. Inteligencia artificial en neuroimágenes. Anuario (Fund. Dr. J. R. Villavicencio) 2024;31. Disponible en: https://villavicencio.org.ar/anuario/31-inteligencia-artificial-en. ARK: http://id.caicyt.gov.ar/ark://wyud7jcsz
Este es un artículo de acceso abierto distribuido bajo los términos de Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-sa/4.0/deed.es), esto permite que Ud. lo use, lo distribuya y lo adapte, sin propósitos comerciales, siempre que se cite correctamente el trabajo original. Si crea un nuevo material con él, debe distribuirlo con la misma licencia.
Resumen
La Inteligencia Artificial (IA) está teniendo un gran impacto en la medicina y especialmente en el campo de la radiología, demostrando ser una herramienta útil en la interpretación de imágenes radiológicas. La IA aplicada al campo de la salud se basa en la utilización de algoritmos y técnicas de software para predecir la cognición humana a través del análisis de conjuntos de datos médicos.
Es por este motivo que siguiendo con los avances tecnológicos y la avidez de descubrir nuevos horizontes, con el Grupo de Neurorradiología de Grupo Oroño, se comenzó a trabajar desde noviembre del año 2022 con un software de IA llamado Entelai Pic.
Su utilización permite la medición automatizada de atrofia en pacientes con deterioro cognitivo y cuantificación de lesiones en pacientes con enfermedad desmielinizante. Nuestra experiencia enriquecedora nos motivó a escribir este artículo describiendo la utilización de esta herramienta de vanguardia.
Palabras clave
Inteligencia artificial, neuroimágenes, demencia, desmielinizante.
Artificial Intelligence in neuroimaging
New challenges
Abstract
Artificial Intelligence (AI) is having a great impact in medicine and especially in the field of radiology, proving to be a useful tool in the interpretation of radiological images.
AI applied to the health field, is based on the use of algorithms and software techniques to predict human cognition through the analysis of medical data sets.
It is for this reason that, continuing with technological advances and the eagerness to discover new horizons, that with the Neuroradiology Oroño Group, we began to work in November 2022 with an AI software called Entelai Pic. Its use allows automated measurement of atrophy in patients with cognitive impairment and quantification of lesions in patients with demyelinating disease. Our enriching experience motivated us to write this article describing the use of this cutting-edge tool.
Keywords
Artificial Intelligence, neuroimaging, dementia, demyelination disease.
Introducción
La Inteligencia Artificial (IA) tiene un gran impacto en la medicina y ha tomado especial interés en el campo de la radiología, ya que ha demostrado ser una herramienta útil en la interpretación de imágenes radiológicas. La IA aplicada al campo de la salud se basa en la utilización de algoritmos y técnicas de software para predecir la cognición humana a través del análisis de conjuntos de datos médicos. 1,2
Debido a que la radiología es inherentemente una profesión de interpretación de datos (en el momento de extraer características de imágenes y aplicar una gran base de conocimientos para interpretar esas características), brinda oportunidades para aplicar estas herramientas y mejorar la práctica. 2,3
Es por este motivo que, siguiendo con los avances tecnológicos y la avidez de descubrir nuevos horizontes, con el Grupo de Neuroradiología de Grupo Oroño, comenzamos a trabajar desde noviembre del año 2022 con un software de IA llamado Entelai Pic. Este sistema es el primer software de IA autorizado por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT), con certificación de normas ISO.
Objetivos
Objetivos
El objetivo de este escrito es mostrar el funcionamiento del flujo de trabajo de los estudios de resonancia magnética nuclear (RMN) de cráneo con protocolo específico para posterior análisis automatizado con software de IA Entelai Pic y de su utilidad en la práctica diaria para el neuroradiólogo y el neurólogo que recibe el informe.
Material o población y métodos
Desde noviembre de 2022 hasta noviembre de 2023, analizamos 165 RMN de cráneo realizadas en nuestra institución, mediante sistema de IA en pacientes derivados por trastornos mnésicos y control de esclerosis múltiple.
Presentación de imágenes
Entelai Pic utiliza algoritmos de visión computacional e inteligencia artificial para analizar automáticamente imágenes médicas y producir reportes estandarizados que incluyen soporte diagnóstico y mediciones complejas. Entelai logra esto mediante el entrenamiento riguroso de sus algoritmos, que a través de sucesivas etapas «aprenden» a leer, segmentar y cuantificar las imágenes médicas. Entelai Pic puede utilizarse tanto como para soporte en tiempo real de los especialistas por imágenes, así como para tareas de investigación o de cribado epidemiológico, lo que permite identificar poblaciones en riesgo o que requieran una atención particular. Entelai se conecta a través de una conexión privada, encriptada y segura a cualquier servidor de imágenes y recibe los archivos DICOM en sus servidores en la nube. Luego, según las características de la imagen, Entelai Pic elige los algoritmos que correspondan para producir el reporte estandarizado y las imágenes preprocesadas. El reporte y las imágenes correspondientes se envían de nuevo al servidor de imágenes. Es decir, el especialista o radiólogo no tiene que enviar la imagen a procesar porque todo ocurre de manera automática.4
Actualmente, se encuentra aprobada para uso clínico en neuroimágenes en la medición de volúmenes cerebrales y de lesiones desmielinizantes. Entelai Pic realiza el análisis automatizado de resonancia nuclear magnética (RMN) de cerebro mediante redes neuronales convolucionales para extracción sucesiva de tejidos, áreas del cerebro y lesiones hiperintensas, a partir de un T1 volumétrico y de un FLAIR volumétrico con parámetros estandarizados. Esto permite su utilización para la medición automatizada de atrofia en pacientes con deterioro cognitivo y cuantificación de lesiones y atrofia en pacientes con esclerosis múltiple u otras enfermedades desmielinizantes. El software compara la volumetría del cerebro del paciente con una base de datos integrada por personas sanas del mismo grupo etario.4,5
Los resultados son generados en formato DICOM para que puedan integrarse con las imágenes originales del estudio y se componen: de un reporte en formato PDF (resumen en texto y gráficos de los hallazgos principales del paciente), segmentación de áreas de cerebro sobreimpuesta sobre T1 volumétrico (permite evaluar la correcta segmentación) y segmentación de lesiones desmielinizantes (sobre un FLAIR volumétrico se señalan las lesiones hiperintensas en enfermedad desmielinizante). El reporte tiene 4 áreas principales. Un área de reporte en texto, un área de gráficos en comparación con una base normativa, un área de control de calidad y el detalle en tablas de todos los hallazgos. El objetivo de la organización del reporte es que en la primera página el médico pueda tener una idea rápida de los hallazgos del estudio y poder profundizar, si es necesario, en los resultados de las tablas. Del reporte en texto merece una mención particular la fracción de parénquima cerebral (FPC), un concepto muy utilizado en investigación pero no tan utilizado en la práctica clínica. Se calcula dividiendo el volumen total de cerebro por el volumen intracraneano total (VIC); es decir, sustancia blanca + sustancia gris/sustancia blanca + sustancia gris + líquido cefalorraquídeo. Esta medida permite tener una idea rápida del grado global de atrofia que presenta el cerebro (Figuras 1, 2 y 3). 4
En el reporte de desmielinizantes, se suma además el volumen total de lesiones hiperintensas en FLAIR, a fin de que se pueda utilizar de forma comparativa con estudios sucesivos (Figuras 4, 5 y 6). 4
En el área de gráficos, se muestran las áreas más relevantes para su identificación de manera más rápida. Las líneas representan los percentilos, el percentil 50 % o mediana se muestra como una línea continua de color azul. El percentil 5-95 % se muestra como una línea punteada de color rojo (por debajo o por encima de lo que se considera como fuera del rango normal). Finalmente, el percentil 1-99 % se representa como una línea roja continua. El «Gráfico estrella» resume los volúmenes de corteza. Aquí, el paciente se muestra en amarillo y los valores de mediana y umbrales de 25 % y 5 % en líneas punteadas. Los últimos dos gráficos de la primera página son el control de calidad y el mapa 3D del cerebro. El control de calidad muestra un resumen de la segmentación de áreas o lesiones desmielinizantes para una validación rápida del especialista. El mapa de color tiene como objetivo resumir la información por áreas para que el especialista oriente su búsqueda de atrofia. Aquí se muestran áreas a revisar, cuando todo el lóbulo está por debajo del percentil 5 % y se señala como posiblemente atrófica cuando todo el lóbulo está por debajo del percentil 1 %. En las páginas 2 y 3 de los reportes de volumetría se informan los valores relativos, el rango normal correspondiente y su percentil para todas las áreas del cerebro y para las lesiones desmielinizantes.4
Para graficar lo descripto previamente presentamos dos pacientes modelos de nuestra muestra.
El primer paciente masculino de 65 años presentaba trastornos mnésicos con Mini-mental test 24 puntos. Se analizaron las imágenes convencionales, que no mostraban signos de leucopatía (Fazekas, grado 0), ni hidrocefalia (Evans 0.2), ligera atrofia temporal (MTA, grado 2), sutil atrofia global (GCA, grado 1) (Koedam, grado 1) (Figuras 7 y 8).
En el reporte de Inteligencia artificial, el volumen de sustancia gris de los lóbulos parietal y frontal se encontró por debajo del percentil 1 y 5 % para el grupo etario. El volumen de ambos hipocampos se encontró por debajo del percentil 1% para el grupo etario (Figura 1).
Aquí fue clave indagar en el motivo de consulta y reportar estos hallazgos al médico derivante, a fin de alertar en la detección temprana de una enfermedad de Alzheimer.6
El segundo paciente femenino de 51 años tenía antecedente de esclerosis múltiple de más de 10 años de evolución en control evolutivo. Se analizaron las imágenes convencionales que mostraban estabilidad en la carga lesional sin evidencia de nuevas lesiones ni lesiones activas y signos de involución cerebral. En el reporte de Inteligencia artificial se mostró segmentación de lesiones en secuencia FLAIR, la cuantificación precisa del número de lesiones y su volumen total. También se cuantificó el grado de atrofia y se observó un volumen cerebral global por debajo del percentil 1 % para el grupo etario (Figuras 9 y 10).
En esclerosis múltiple, la carga lesional, la presencia y progresión de atrofia son dos variables cada vez más reconocidas e incorporadas en la práctica clínica. Así, la detección de lesiones y carga lesional han sido utilizadas tradicionalmente como variables para la elección terapéutica y la modificación de esta. La medición del volumen de lesiones se está comenzando a incorporar en reemplazo del número de lesiones como una forma más precisa de medir el impacto de la enfermedad. Lo mismo ocurre con la atrofia cerebral, variable predictora de progresión, discapacidad y mal pronóstico.4,8
Consideramos de importancia la incorporación de estas mediciones con IA en nuestros informes de rutina, ya que esto puede contribuir a las decisiones terapéuticas del neurólogo.
Discusión
En los pacientes analizados realizamos un reporte propio tradicional e incluimos la información del reporte estandarizado de Entelai. Realizamos un análisis de los hallazgos de las secuencias convencionales (T1-T2-FLAIR-Difusión-GRE). Utilizamos escalas para estimar leucopatía (Fazekas), atrofia global (Global Cortical Atrophy GCA), atrofia temporal (Scheltens-MTA), atrofia parietal (Koedam) y dilatación ventricular (índice de Evans). En las lesiones desmielinizantes analizamos la carga lesional, número de lesiones, aparición de nuevas lesiones y presencia de lesiones activas con realce postgadolinio. Resulta fundamental una primera evaluación general para descartar lesiones ocupantes de espacio (LOE), lesiones isquémicas agudas, lesiones hemorrágicas y presencia de artefactos, entre otras alteraciones. En una segunda etapa, hacemos un análisis de reportes estandarizados de Entelai con el control de calidad de la segmentación e interpretación del texto, gráficas y tablas.4-8
Nuestra experiencia fue muy positiva, lo que permite una amplificación de información, especialmente en la medición de volumetrías de cerebro y de lesiones, tarea que normalmente no sería practicable de rutina.
También nos permitió alertar la presencia de desviaciones de la media del grupo etario-control. Mientras más bajo (o alto en caso de los ventrículos) sea el percentil, más probabilidad de que el volumen esté alterado y que merezca ser revisado y correlacionado con el motivo de consulta y los hallazgos clínicos del paciente.
Este percentil se estima mediante el análisis de un conjunto de 2500 controles sanos, que incluye pacientes de latinoamérica, en quienes se implementó el algoritmo de Entelai y se definieron los volúmenes normales. Así, cada vez que se analiza un nuevo cerebro, se lo compara con lo que considera que sería el tamaño normal. Este dato objetivo nos brinda información relevante dado que normatiza al paciente para su grupo etario.4
Conclusiones
En nuestra pequeña prueba piloto, la IA constituyó una herramienta adicional para el neurorradiólogo, dado que permitió cuantificar objetivamente volúmenes de estructuras y lesiones, difíciles de realizar con el ojo humano. Consideramos esta tecnología innovadora como un aliado en la práctica diaria, no como un lector alternativo al radiólogo.9 El gran desafío de nuestra especialidad es el conocimiento y manejo de estas herramientas de vanguardia para mejorar la precisión y eficiencia diagnóstica, combinándola con la experiencia y juicio clínico-radiológico del profesional.
Figuras
Figura 1: Reporte sobre volumetría de Entelai Pic
Reporte sobre volumetría de Entelai Pic: Texto y área de gráficos en comparación con base normativa, área de control de calidad y un mapa de calor para resumir la información por áreas.
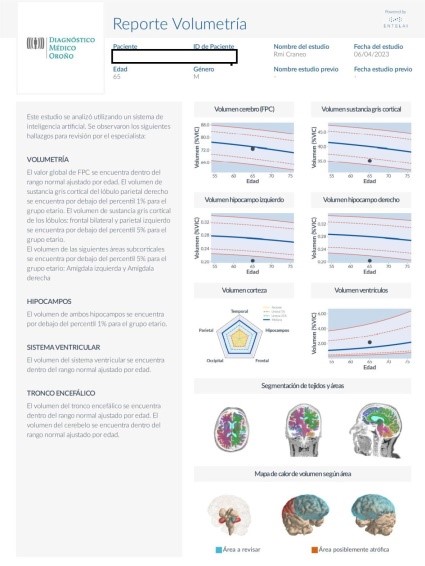
Figura 2: Tabla de volumetría de Entelai Pic
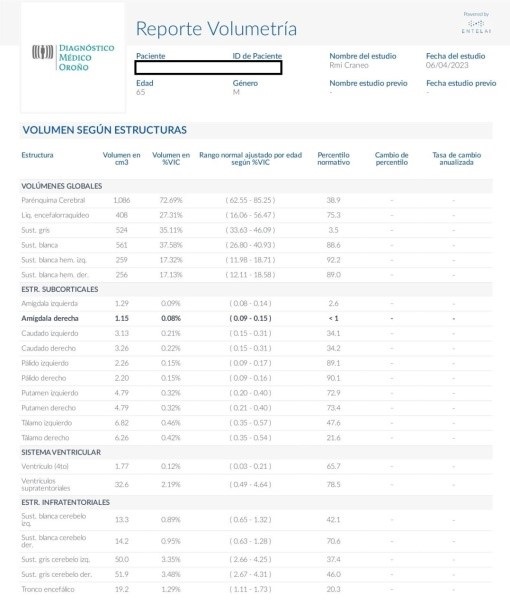
Tabla de volumetría de Entelai Pic en la que se informan los valores relativos, el rango normal correspondiente y su percentil para todas las áreas.
Figura 3: Tabla de volumetría de Entelai Pic (continuación)

Tabla de volumetría de Enteali Pic (continuación)
Figura 4: Reporte desmielinizante de Entelai Pic

Reporte desmielinizante de Entelai Pic. Texto en el que se describe la detección de lesiones en número y volumen, como así también la volumetría. Ärea de gráficos en comparación con base normativa, área de control de calidad, detección de lesiones y mapa de calor.
Figura 5: Tabla de volumetría de Enteali Pic en reporte desmielinizante

Tabla de volumetría de Enteali Pic en la que se informa al análisis volumétrico de lesiones y se puede comprar con estudios previos. También muestra el volumen según estructuras, los valores relativos, el rango normal correspondiente y su percentil para todas las áreas.
Figura 6: Tabla de volumetría de Enteali Pic en reporte desmielinizante (continuación)
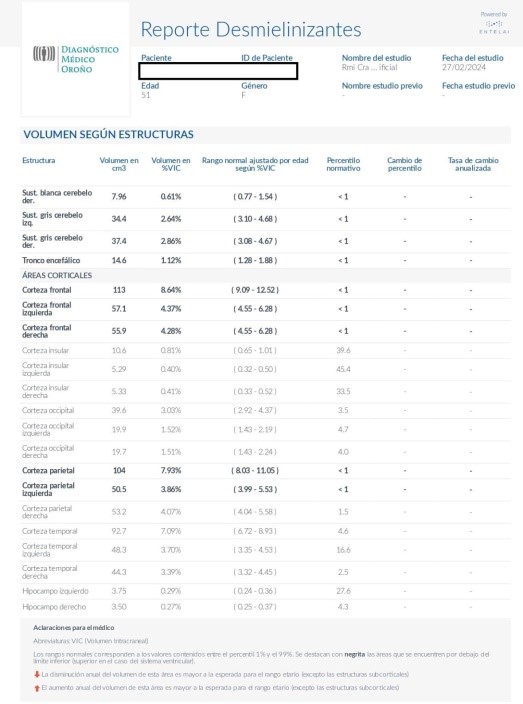
Tabla de volumetría de Enteali Pic (continuación)
Figura 7: Resonancia magnética de cerebro. Corte axial Flair
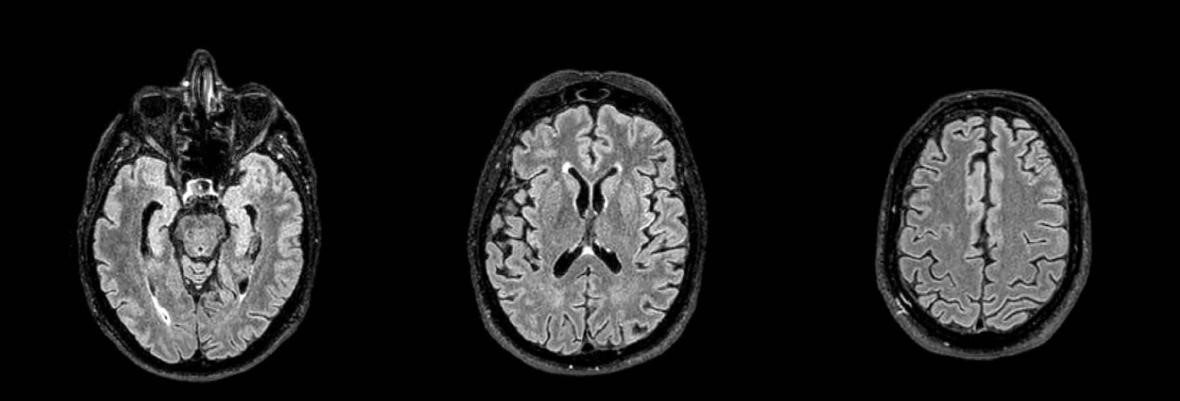
Parénquima cerebral sin particularidades. No se observan signos de leucopatía ni lesiones ocupantes de espacio.
Figura 8: Resonancia magnética de cerebro. Corte coronal flair y T1. Axial T1.
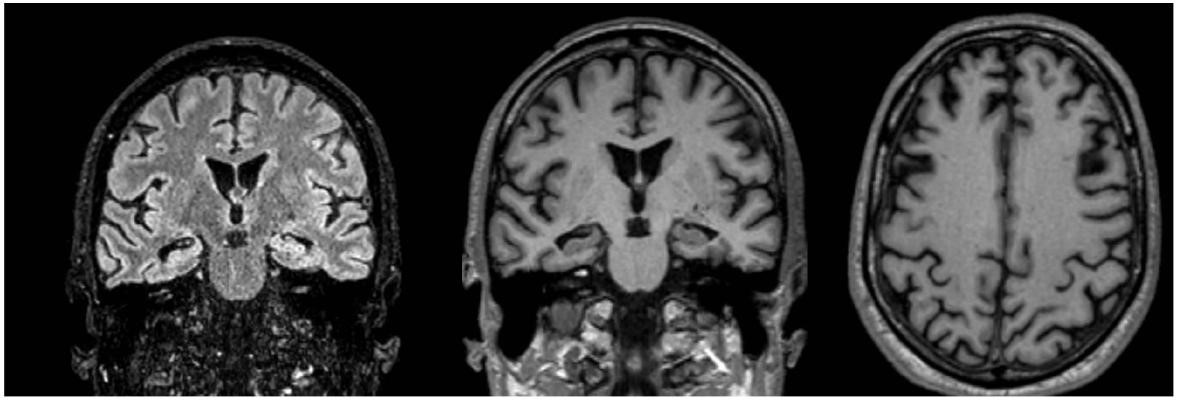
Signos discretos de atrofia temporal profunda (MTA -Scheltens grado 2). Axial T1: signos discretos de atrofia global (CGA grado 1 y Koedam grado 1).
Figura 9: Resonancia magnética de cerebro. Corte sagital flair.
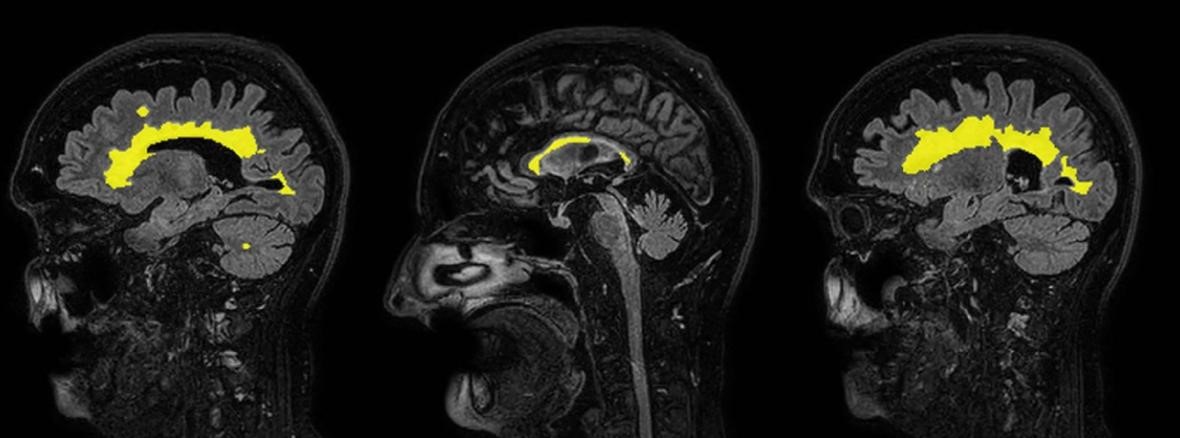
Sagital FLAIR con segmentación de lesiones desmielinizantes
Figura 10: Reporte desmielinizante. Detección de lesiones y volumen cerebral global.
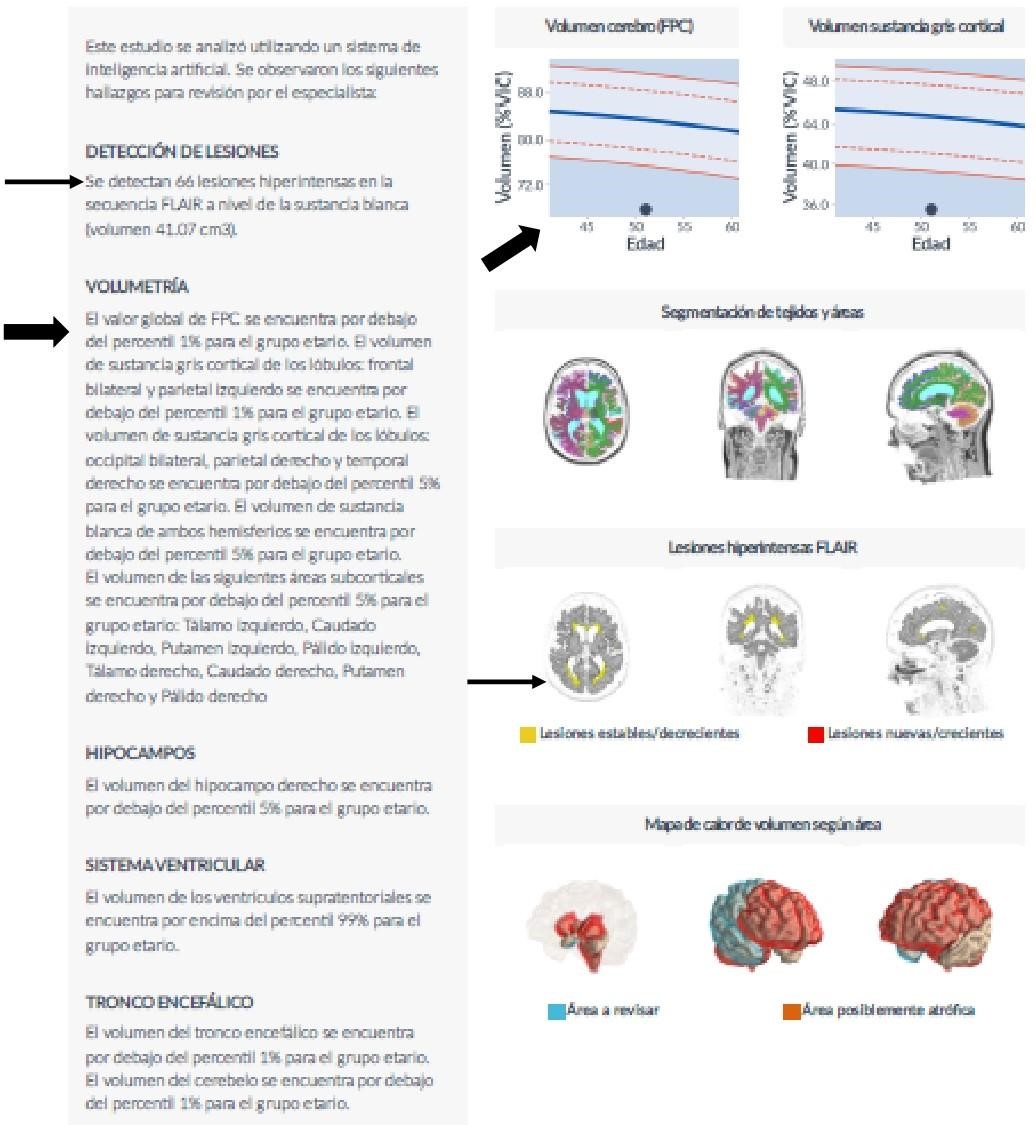
Se señala con flechas la detección de lesiones y la volumetría. El volumen global del volumen cerebral (FPC) se encuentra por debajo del percentil 1 % para el grupo etario.
Bibliografía
1. Topol E. High-performance medicine: the convergence of human and artificial intelligence. Nat Med. 2019;25:44-56.
2. Russell SJ, Norvig P. Artificial intelligence: A modern Approach. 4th ed. USA: Pearson; 2021.
3. Kholi J, Prevedello LM, Filice RW, et al. Implementing machine learning in radiology practice and research. AJR Am J Roentgenol. 2017; 208:754-760.
4. Entelai D. Entelai Aenti. c2023 [actualizado 2024-03-23; citado 23/03/2024]. Disponible en: https;//entelai.com/
5. Chaves H, Dorr F, Costa ME. Brain volumes quantification from MRI in healthy controls: Assessing correlation, agreement and robustness of a convolutional neural network-based software against FreeSurfer, CAT12 and FSL. J Neuroradiol. 2021; 48:147-156.
6. Marshall CR, Uchegbu I. Artificial intelligence for detection of Alzheimer’s disease: demonstration of real-world value is required to bridge the translational gap. Lancet Digit Health. 2022; 4:768-769.
7. Li R, Lawler K, Garg S, et al. Applications of artificial intelligence to aid early detection of dementia: A scoping review on current capabilities and future directions. J Biomed Inform. 2022; 127:104.
8. Naji Y, Mahdaoui M, Klevor R, et al. Artificial intelligence and multiple sclerosis: Up-to- date review. Cureus. 2023; 15:454.
9. Recht M, Bryan RN. Artificial Intelligence: Threat or boon to radiologist? J Am Coll Radiol. 2017; 14:1476-1480.








































